1
Казахстанские ученые предложили посолить океан
8 сентября 2023 года |
||||||||||||||||||||||
2
Введение
Размер углеродных резервуаров на Земле
|
|||||
1
Казахстанские ученые предложили посолить океан
8 сентября 2023 года |
||||||||||||||||||||||
2
Введение
Размер углеродных резервуаров на Земле
|
|||||
|
||||||
| 4
| |||||||||||
5
|
|||||||||
6
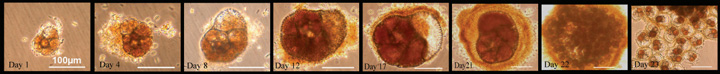
|
||||||||
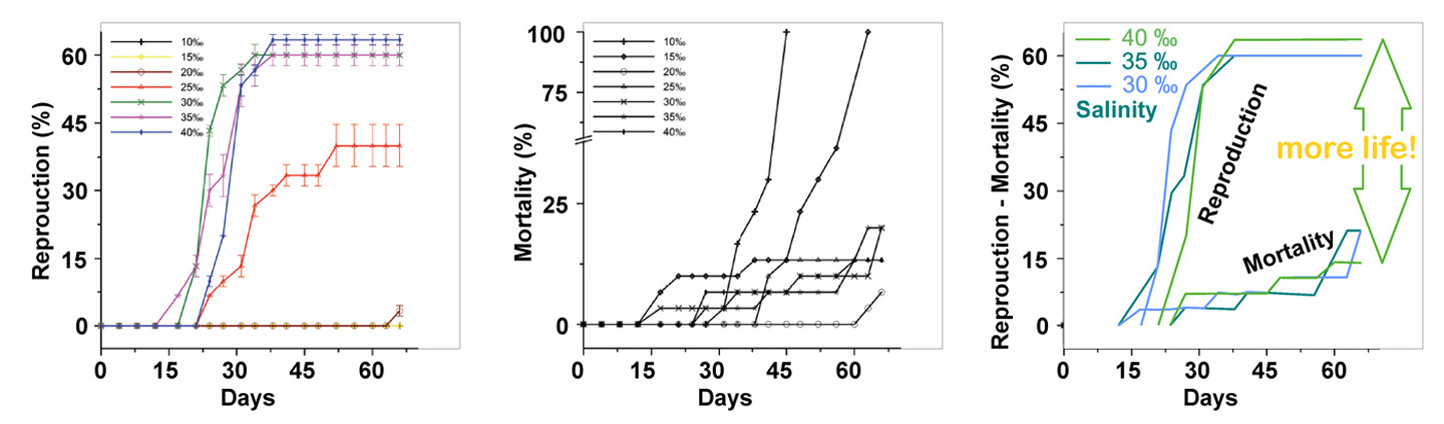
7
|
||||
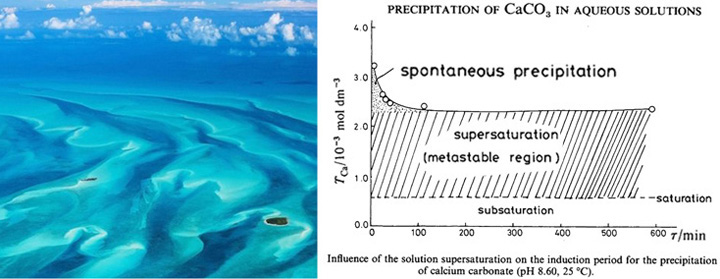
8 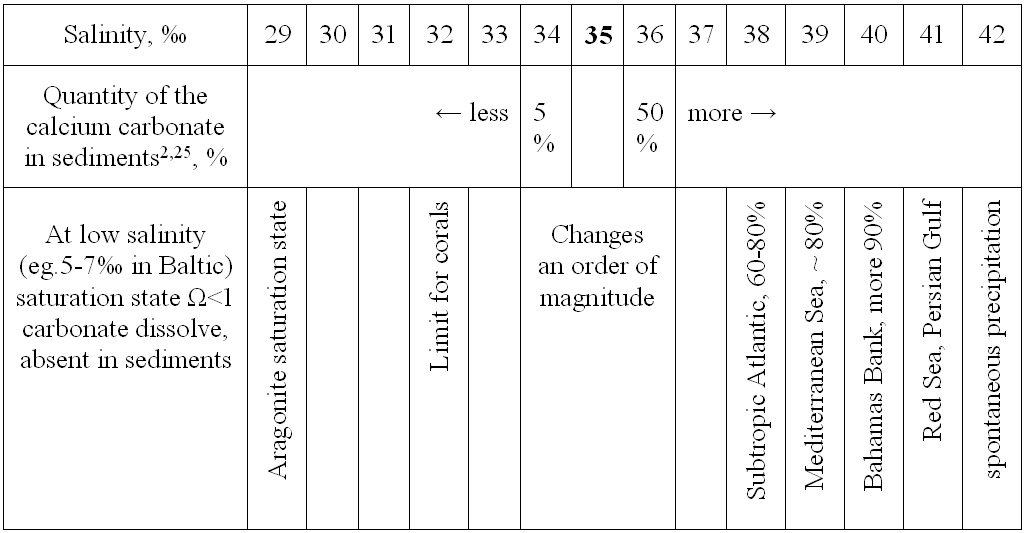
|
|||||
9
|
|||||||||||||||||||||||||||||||||||||
10
|
||||||
11
|
||||
12
|
||||
13
|
|||||||||||||||
14
|
|||
15
|
|||||||||||||||||||||||||||||||||||
16
|
|||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
20
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
21
Считывание входных данных для моделирования 2. для начала расчетов реакции периодического действия. ФАЗЫ РАВНОВЕСИЯ: CO2 (г), кальцит. CCPP. .
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||
25
|
||||||||
|
|||||||||||||||||||||||||
27
|
|||||
28
|
|||||
29
|
|||||
30 Добро пожаловать в Казахстан
|
||||
31
|
||||||
32
|
||||||
33 Глобальные лайфхаки
|
||||
34
|
||||||
35
|
|||
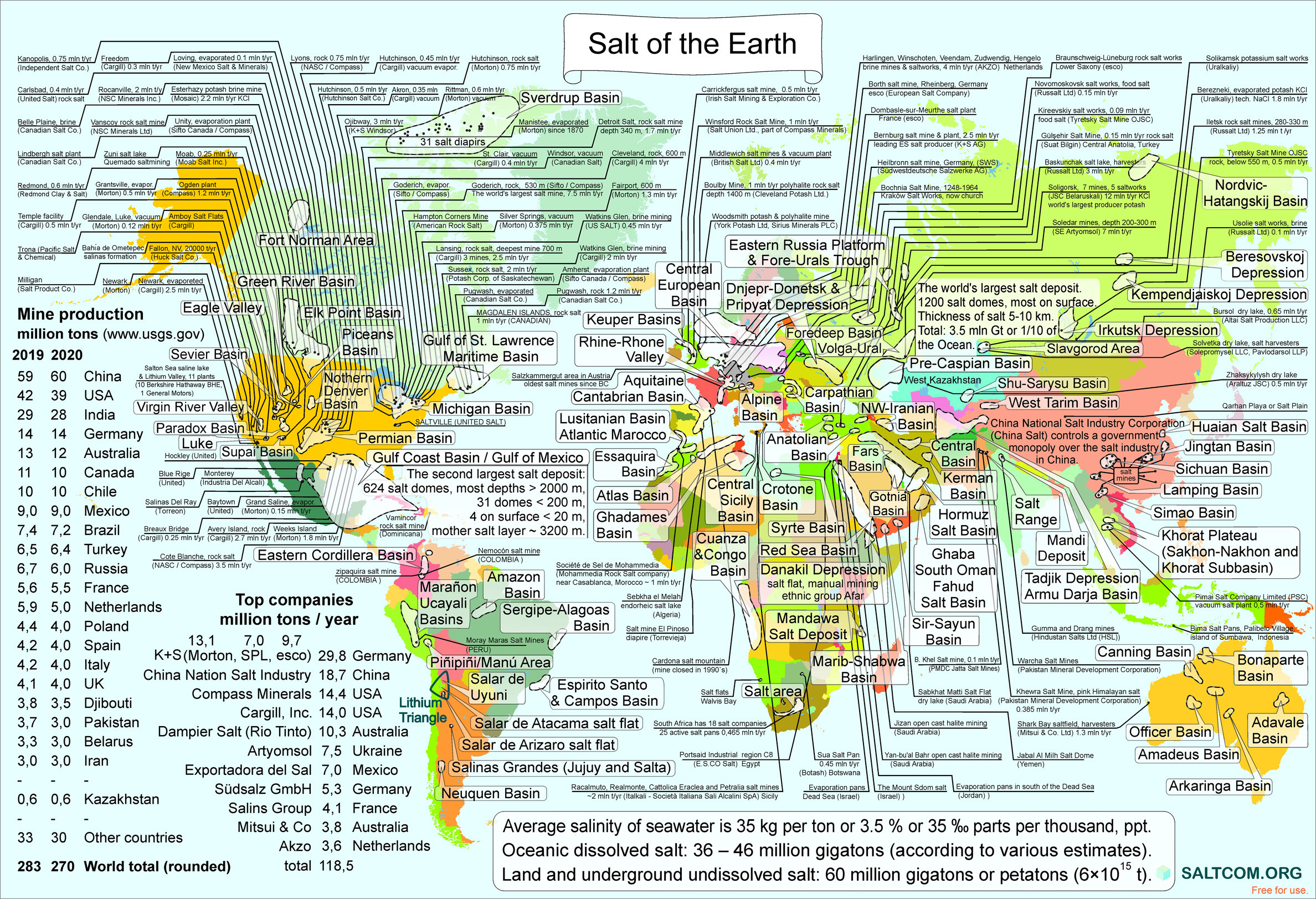 | |||
37 Обсуждение
|
||||
38
|
|||
39
|
||||
40
Замор рыбы из-за дисбаланса ионов и быстрого размножения микроорганизмов во время вредного цветения водорослей.
|
||||
41
|
||||
42 Видение
|
||||
43
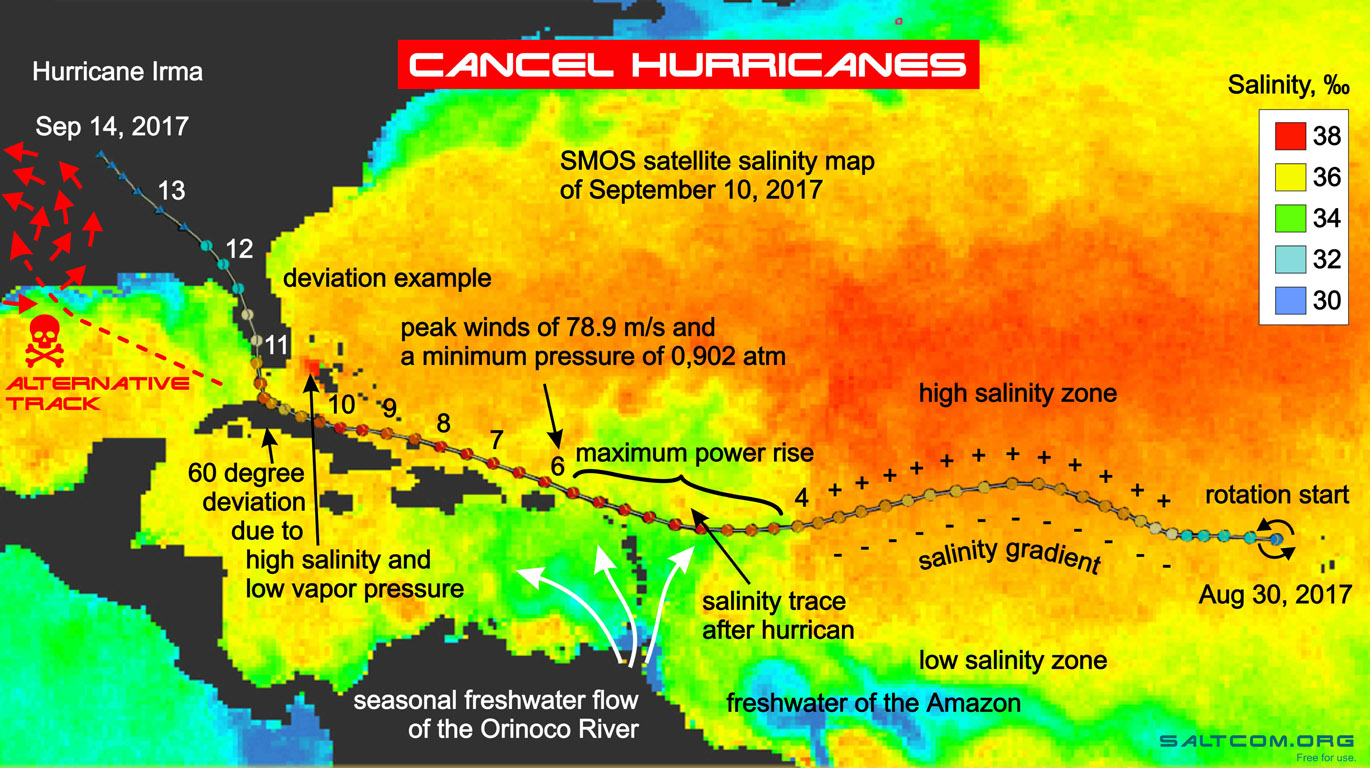
|
||||
44
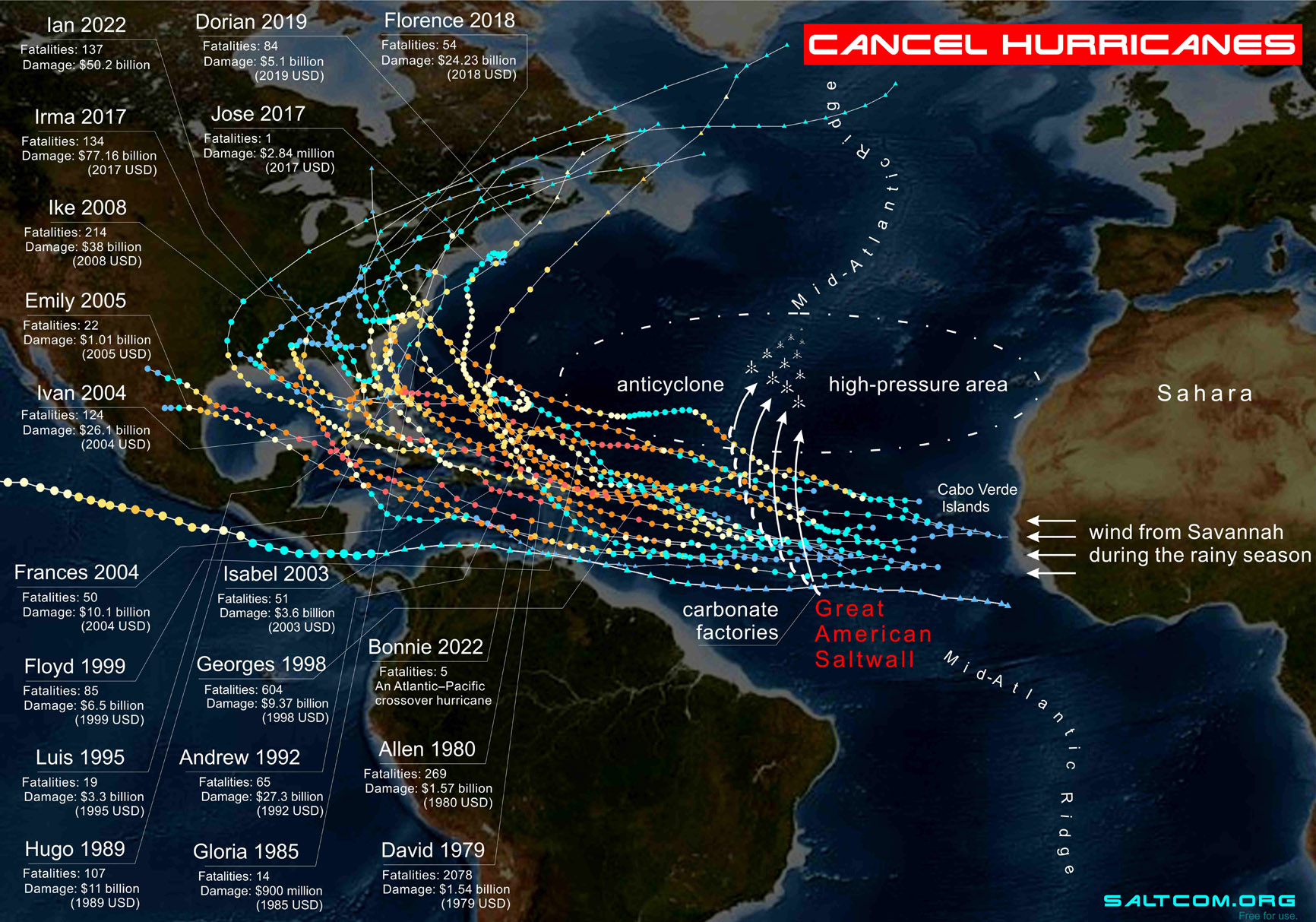
|
||||
45
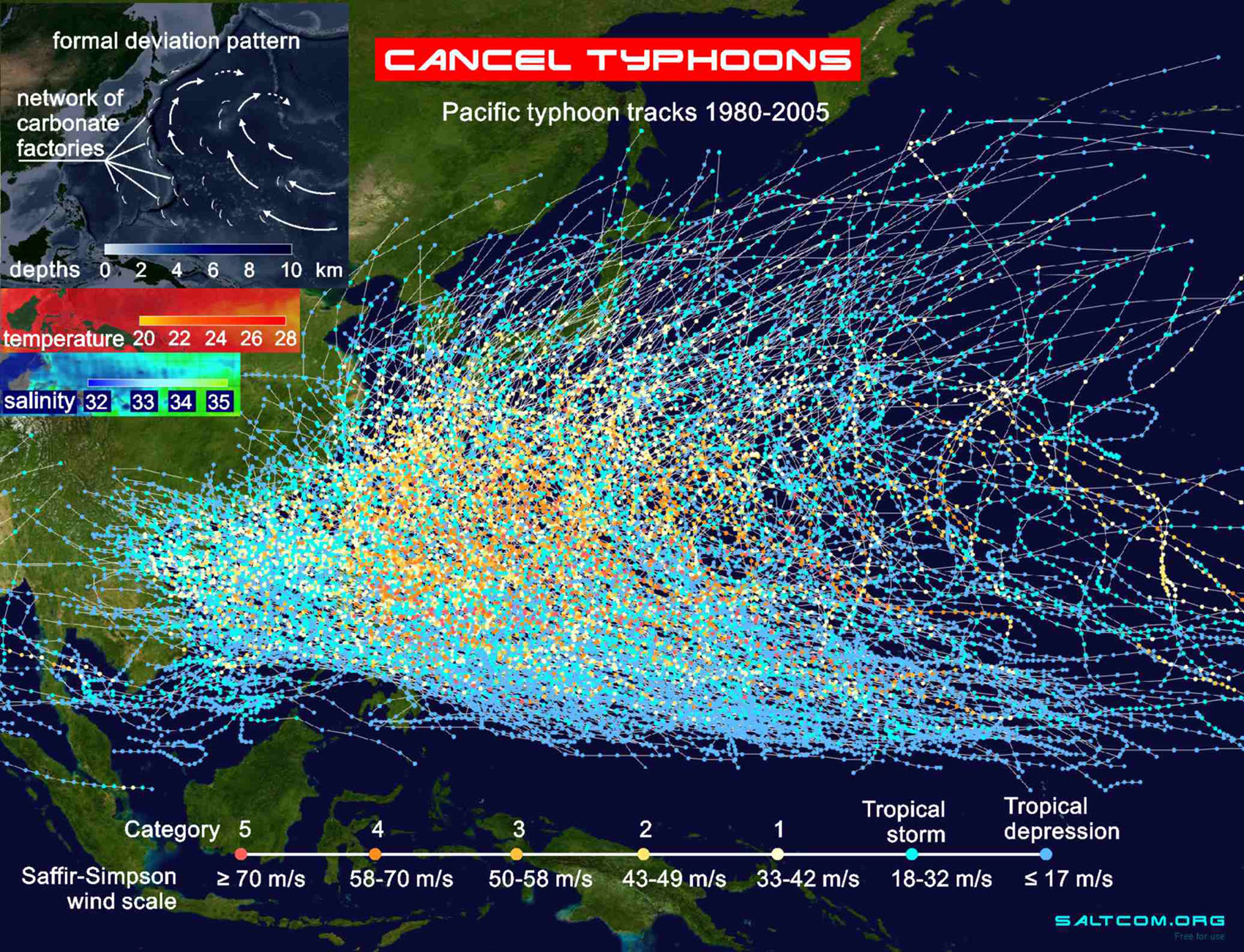
|
||||
46

|
||||
47
|
|||
48
|
|||
49
|
|||
50
|
|||
52
|
|||
53
|
|||
|
|
| Все тексты и изображения доступны для свободного использования. Вы можете копировать, вставлять, сохранять, редактировать, изменять, отправлять, получать, продавать, покупать, извлекать выгоду, соглашаться, оспаривать, развивать, игнорировать, принимать близко к сердцу, делать с ними что угодно без ограничений. Freeedom!!! |