1
الكازاخستانية العلماء تشير إلى إضافة الملح إلى المحيط
|
|||||||||||||||||||||||||||||||
2
مقدمة
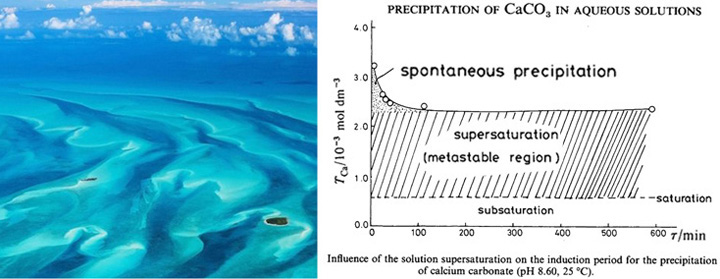
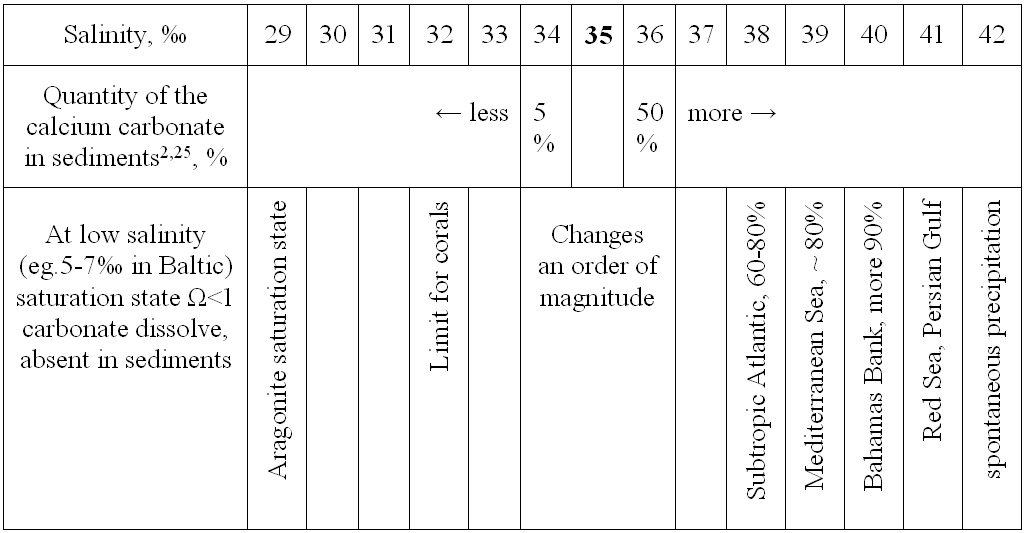
حجم مستودعات الكربون على الأرض
|
|||||
1
الكازاخستانية العلماء تشير إلى إضافة الملح إلى المحيط
|
|||||||||||||||||||||||||||||||
2
مقدمة
حجم مستودعات الكربون على الأرض
|
|||||
|
||||||
| 4
| |||||||||||
5
|
|||||||||||
6
|
||||||||
7
|
||||
8
|
|||||
9
|
|||||||||||||||||||||||||||||||||||||
10
|
||||||
11
|
||||
12
|
||||
13
|
|||||||||||||||
14
|
|||
15
|
|||||||||||||||||||||||||||||||||||
16
|
|||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
20
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
21
.Reading input data for simulation 2. for Beginning of batch-reaction calculations .EQUILIBRIUM_PHASES: CO2(g), Calcite. CCPP
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||
25
|
||||||||
|
|||||||||||||||||||||||||
27
|
|||||
28
|
|||||
29
|
|||||
30 مرحبا بكم في كازاخستان
|
||||
31
|
||||||
32
|
||||||
33 الأساليب والحلول العالمية
|
||||
34
|
||||||
35
|
|||
 | |||
37 المناقشة
|
||||
38
|
|||
39
|
||||
40
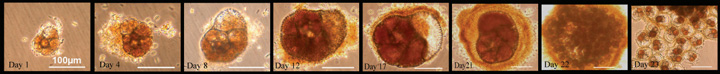
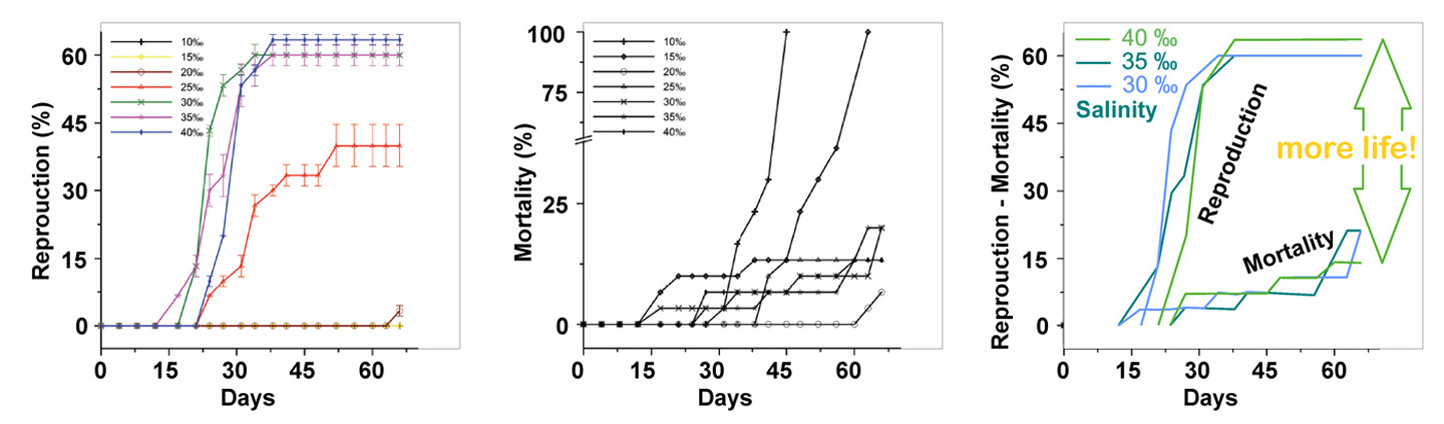
تقتل الأسماك بسبب عدم توازن الأيونات والتكاثر السريع للكائنات الحية الدقيقة أثناء تكاثر الطحالب الضارة.
|
||||
41
|
||||
42 الرؤية
|
||||
43
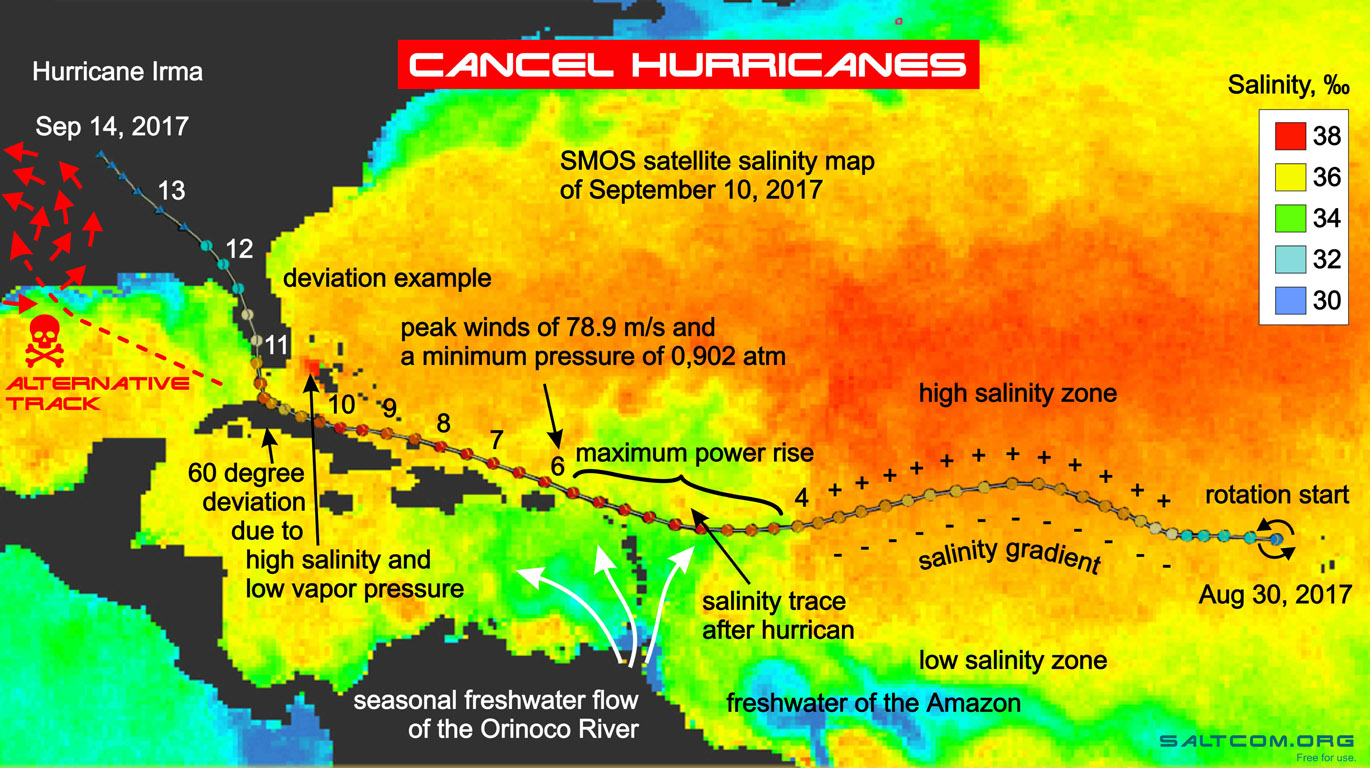
|
||||
44
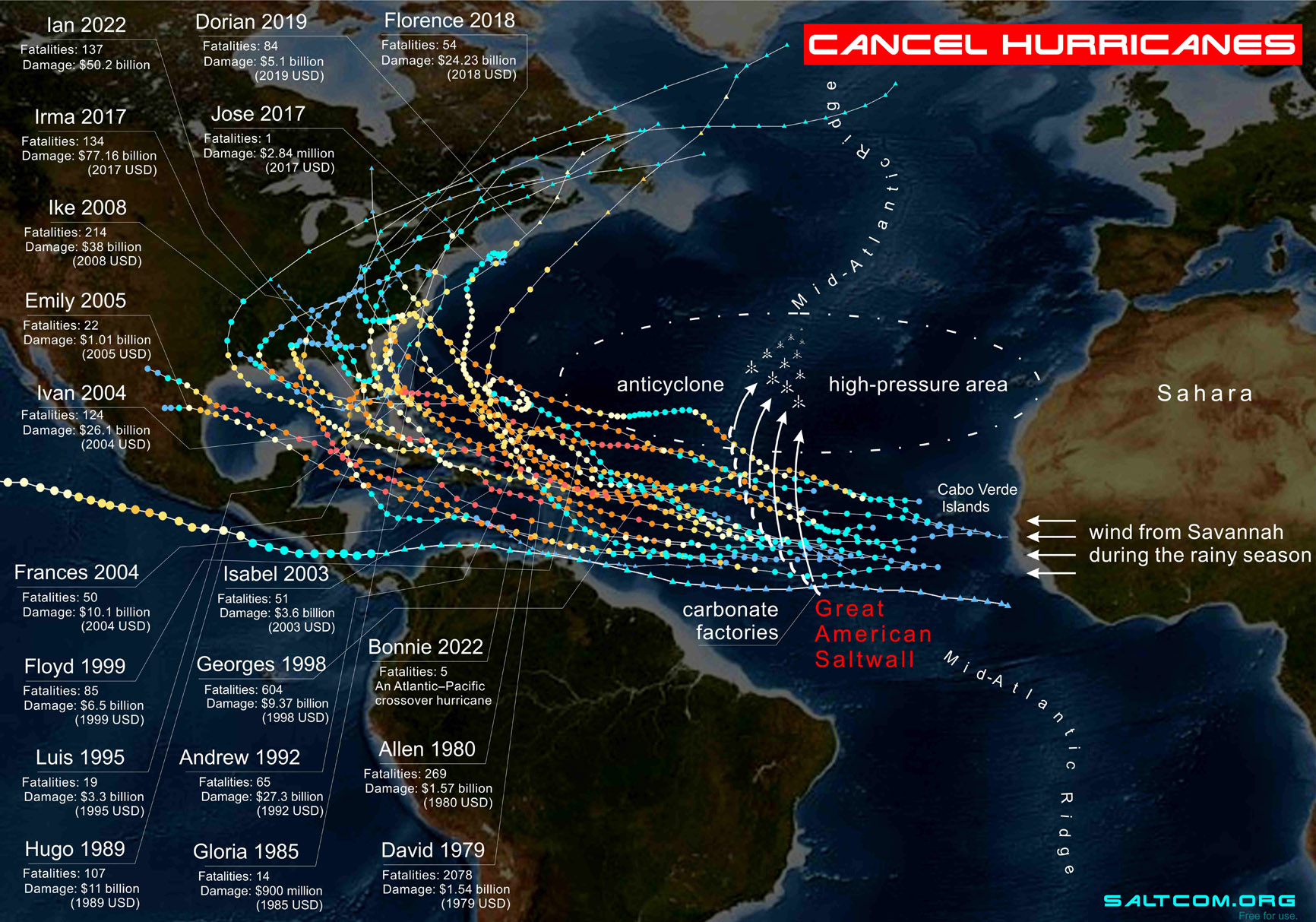
|
||||
45
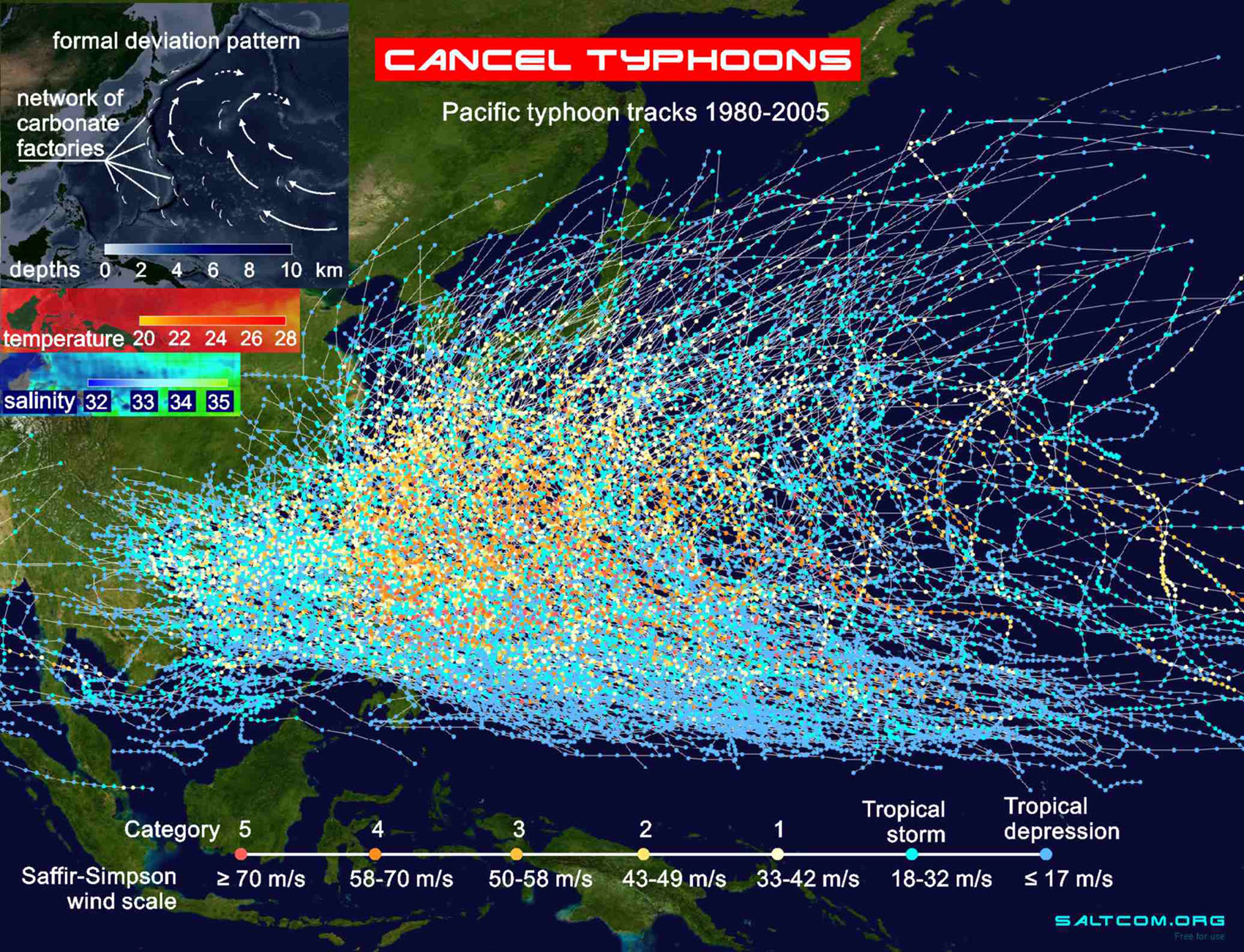
|
||||
46

|
||||
47
|
|||
48
|
|||
49
|
|||
50
|
|||
52
|
|||
53
|
|||
|
|
| جميع النصوص والصور متاحة للاستخدام مجانا. يمكنك نسخ, لصق, حفظ, تحرير, تعديل, إرسال, استلام, بيع, شراء, فائدة, توافق, التحدي, تطوير, تجاهل, تأخذ القلب ، تفعل ما تريد دون قيود. !!!Freeedom |