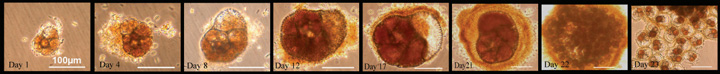
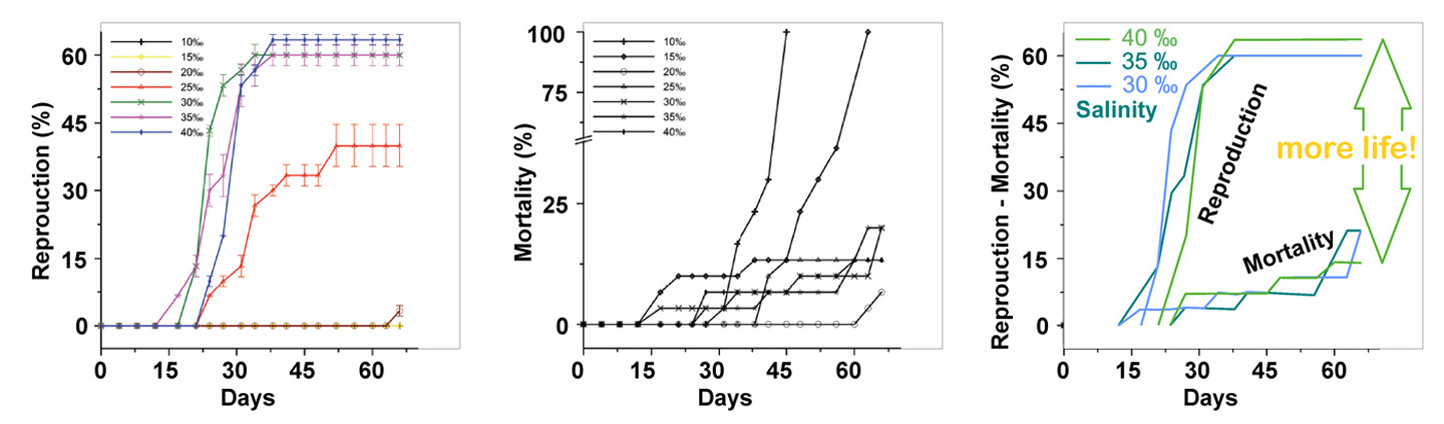
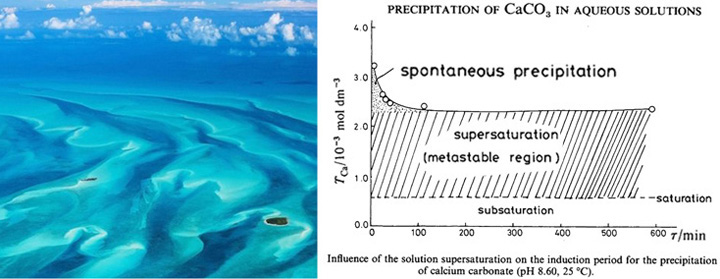
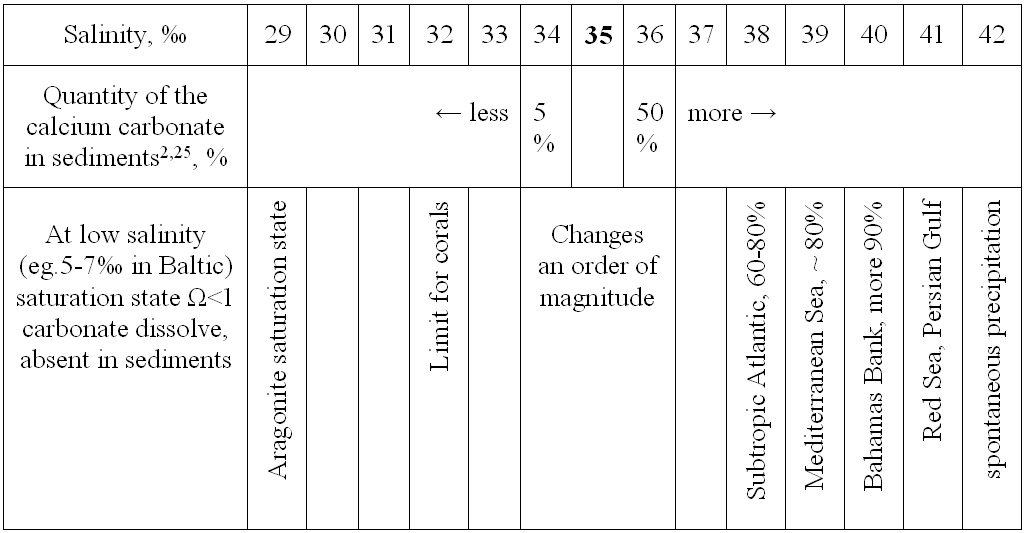
[17] Introduction to the physical oceanography. 2014, Koshlyakov et al., Moscow Physic Technology University 
[18] Total alkalinity: The explicit conservative expression and its application to biogeochemical processes. 2007, Dieter A. Wolf-Gladrow, Richard E. Zeebe, Christine Klaas, Arne Körtzinger, Andrew G. Dickson. 
[19] Guide to Best Practices for Ocean CO2 Measurements. 2007, Andrew G. Dickson et al., Scripps Institution of Oceanography, San Diego 
[20] Precipitation of calcium carbonate and its impact on heat exchangers of cooling sysems. 1984, Cheng Hoong Kuo, University of New South Wales, Australia 
[21] Global relationships of total alkalinity with salinity and temperature in surface waters of the world’s oceans. 2006, Frank J. Millero, Andrew G. Dickson and over, Scripps-Miami 
[22] Precipitation of Calcium Carbonate in Aqueous Solutions. 1983, P. Koutsoukos, G. Kontoyannis, University of Patras, Greece 
[23] The physical chemistry of natural waters. 1985, Frank J. Millero, University of Miami 
[24] The physical chemistry of seawater. 1974, Frank J. Millero, University of Miami 
[25] Relation of salinity to the calcium carbonate content of marine sediments. 1936, Parker D. Trask, U.S. Geological Survey 
[26] Thermodynamics of electrolytes. II. Activity and osmotic coefficients for strong electrolytes with one or both ions univalent., 1973, Kenneth S. Pitzer, Mayorga Guillermo, Lawrence Berkeley National Laboratory 
[27] Activity coefficients in electrolyte solutions. 1991, Kenneth Pitzer, University of California 
[28] A theoretical study of the kinetics of the boric acid–borate equilibrium in seawater., 2000, Richard E. Zeebe, Abhijit Sanyal, Joseph D. Ortiz, Dieter A. Wolf-Gladrow, BremerhaÍen, Germany 
[29] A Gibbs function for seawater the rmodynamics for -6 to 80 C and salinity up to 120 g kg–1., 2008, Rainer Feistel, Leibniz-Institut fur Ostseeforschung,Warnemunde,Germany 
[30] Factors controlling the rate of CaCO3 precipitation on Great Bahama Bank. 2000, Wallace S. Broecker, Chris Langdon, TaroTakahashi, Columbia University, Palisades, New York 
[31] Salinity-temperature ranges for application of seawater SA-T-P models. 2009, G. M. Marion, F. J. Millero, R. Feistel 
[32] Revised Chemical Equilibrium Data for Major Water-Mineral Reactions and Their Limitations. 1990, Nordstrom D. K., Plummer L. N., Langmuir D., Busenberg, Howard M. M., Blair F. J., and Parkhurst D. L. 
[33] Kinetics of calcite precipitation from seawater: II. The influence of the ionic strength. 1997, Pierpaolo Zuddas and Alfonso Mucci, McGill University, Montreal 
[34] Reviw of Kinetic Data on Carbonate Mineral Precipitaton. 1996, Sanjuan B., Girard J. P., Report BRGM