1
Kasachische Wissenschaftler haben vorgeschlagen, den Ozean zu salzen
8. September 2023 |
||||||||||||||||||||||
2
Einführung
Größe kohlenstoffspeicher auf der Erde
|
|||||
1
Kasachische Wissenschaftler haben vorgeschlagen, den Ozean zu salzen
8. September 2023 |
||||||||||||||||||||||
2
Einführung
Größe kohlenstoffspeicher auf der Erde
|
|||||
|
||||||
| 4
| |||||||||||
5
|
|||||||||
6
|
||||||||
7
|
||||
8
|
|||||
9
|
|||||||||||||||||||||||||||||||||||||
10
|
||||||
11
|
||||
12
|
||||
13
|
|||||||||||||||
14
|
|||
15
|
|||||||||||||||||||||||||||||||||||
16
|
|||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
20
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
21
Lesen von Eingangsdaten für die simulation 2. für den Anfang der batch-Reaktion Berechnungen. EQUILIBRIUM_PHASES CO2(g), Kalzit. CCPP.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||
25
|
||||||||
|
|||||||||||||||||||||||||
27
|
|||||
28
|
|||||
29
|
|||||
30 Willkommen in Kasachstan
|
||||
31
|
||||||||
32
|
||||||
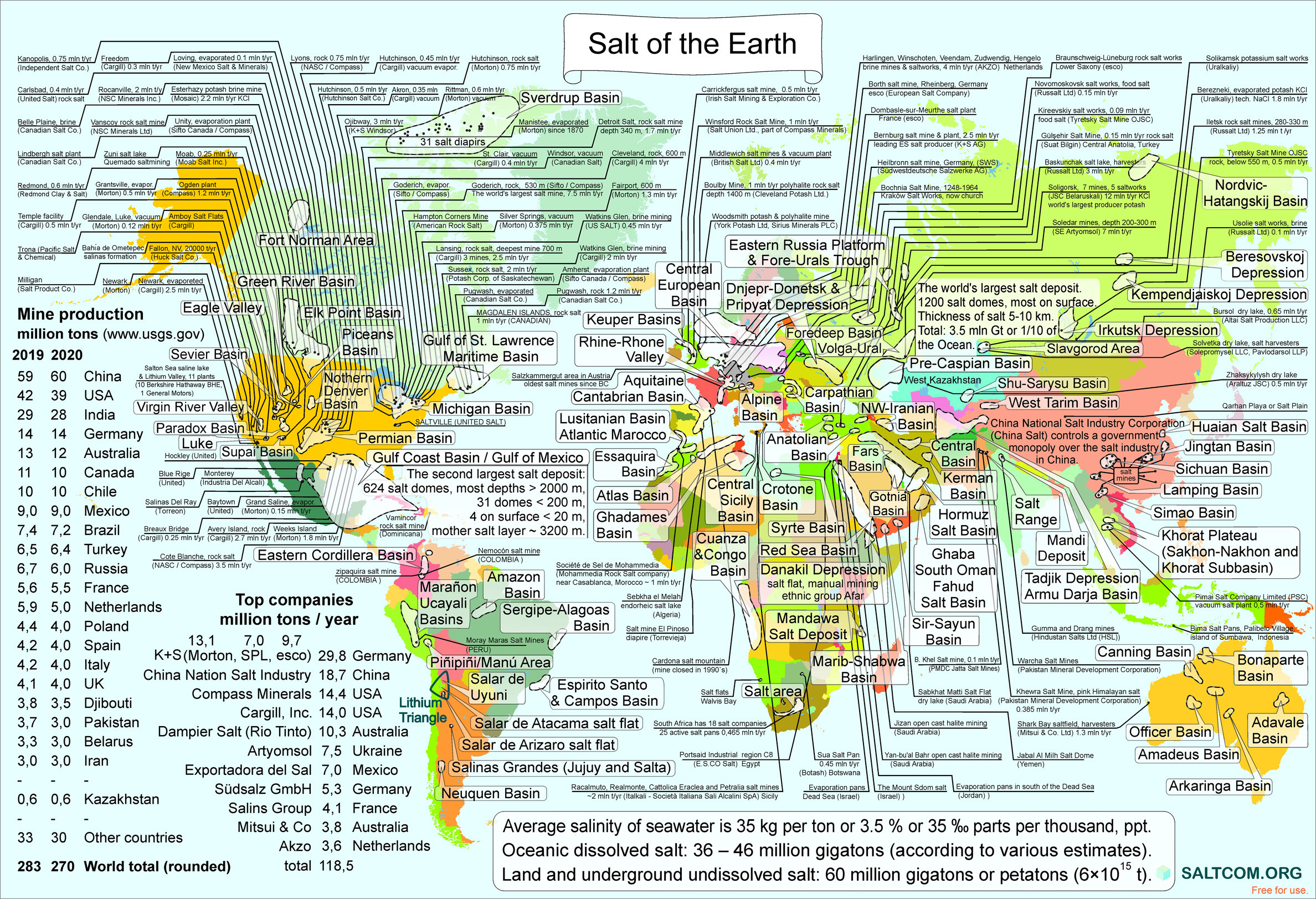
33 Globale Life-Hacks
|
||||
34
|
||||||
35
|
||||
 | |||
37 Diskussionen
|
||||
38
|
|||
39
|
||||
40
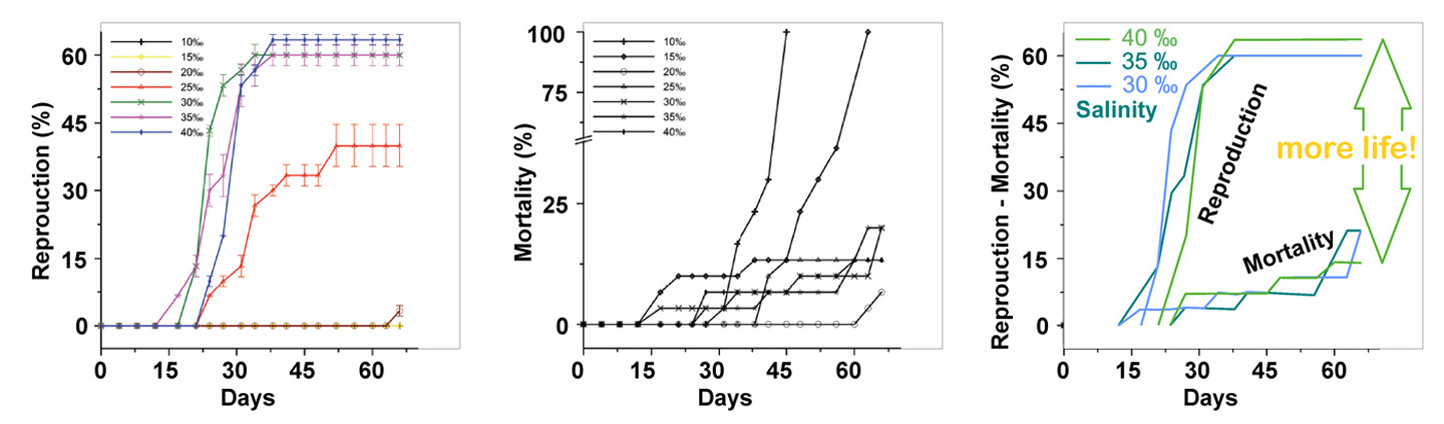
Die Fische töten durch ein Ungleichgewicht der Ionen und die schnelle Vermehrung von Mikroorganismen während der schädlichen Algenblüte.
|
||||
41
|
||||
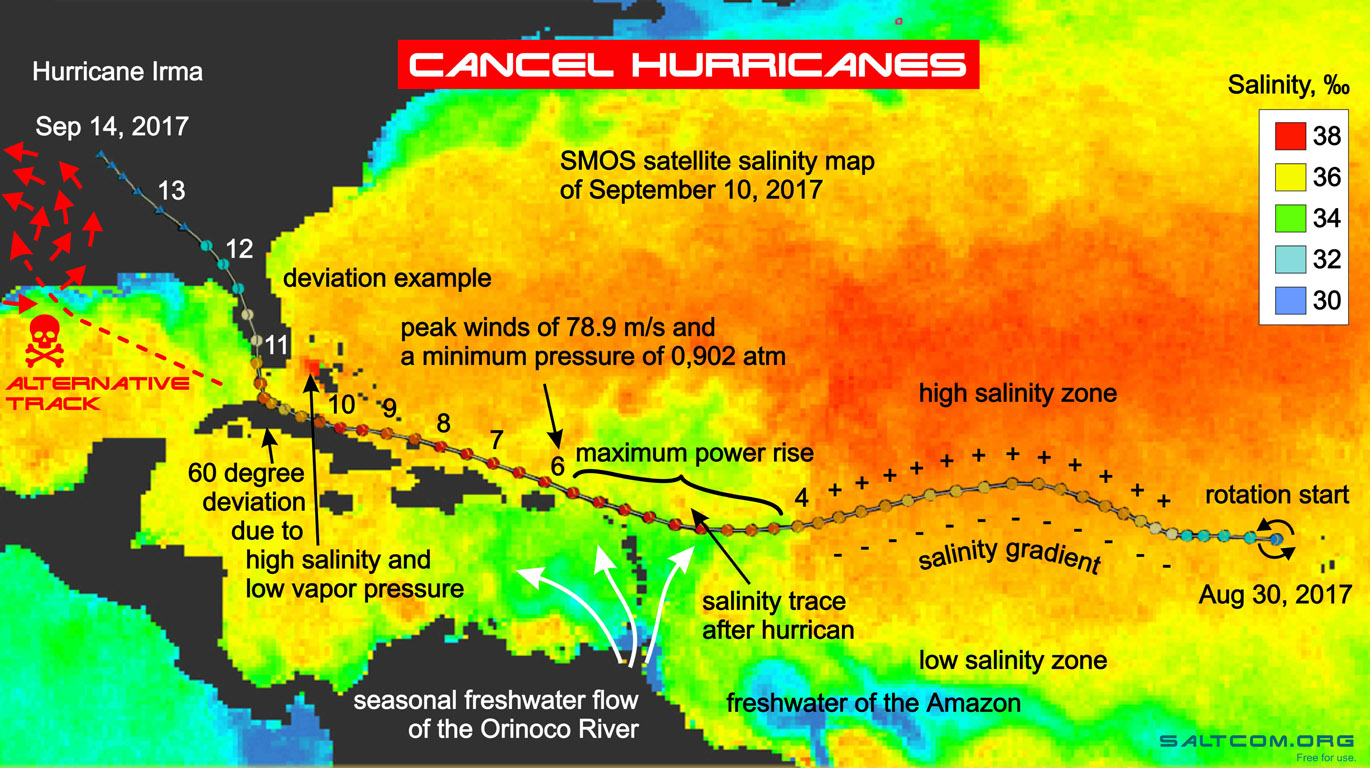
42 Vision
|
||||
43
|
||||
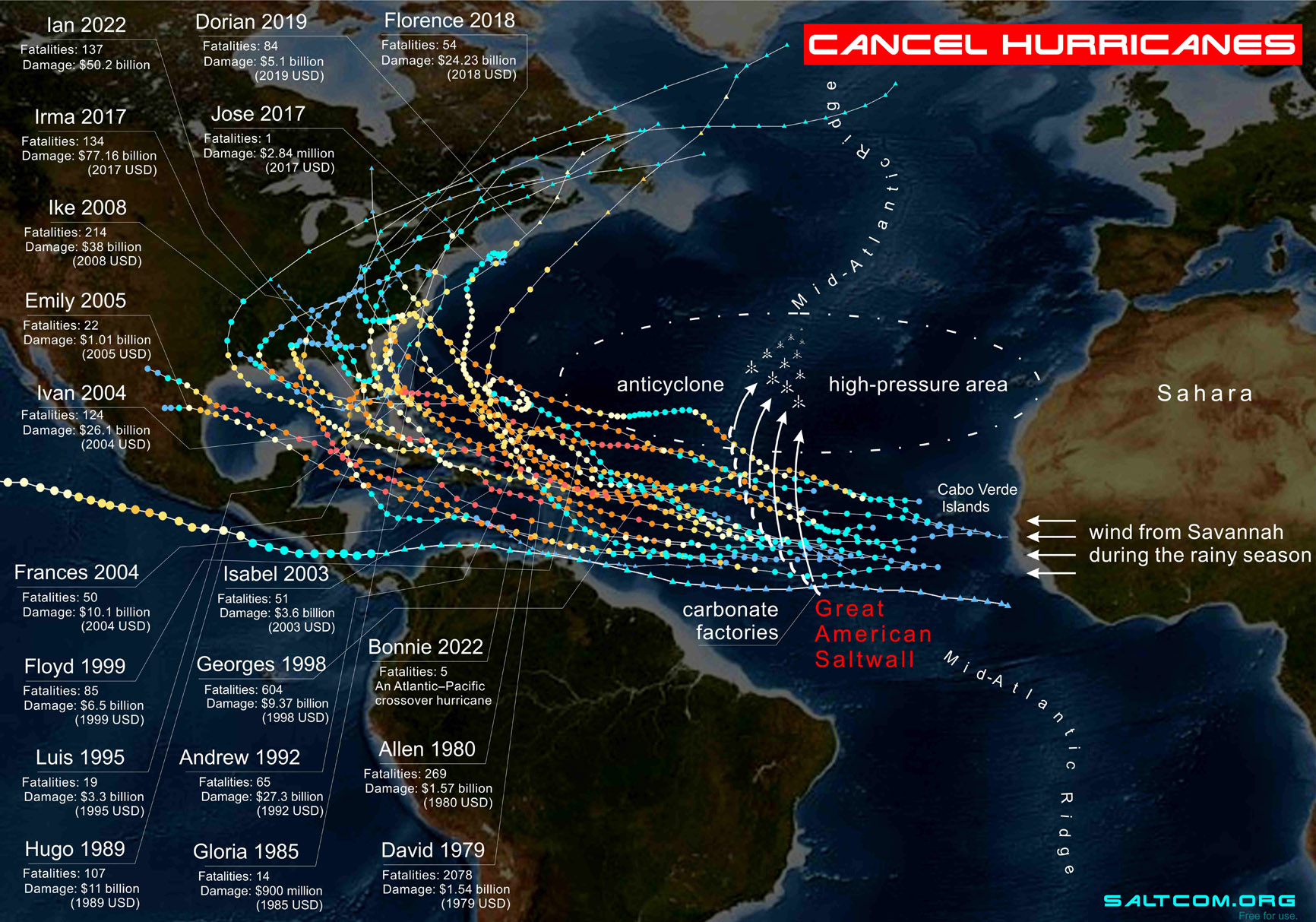
44
|
||||
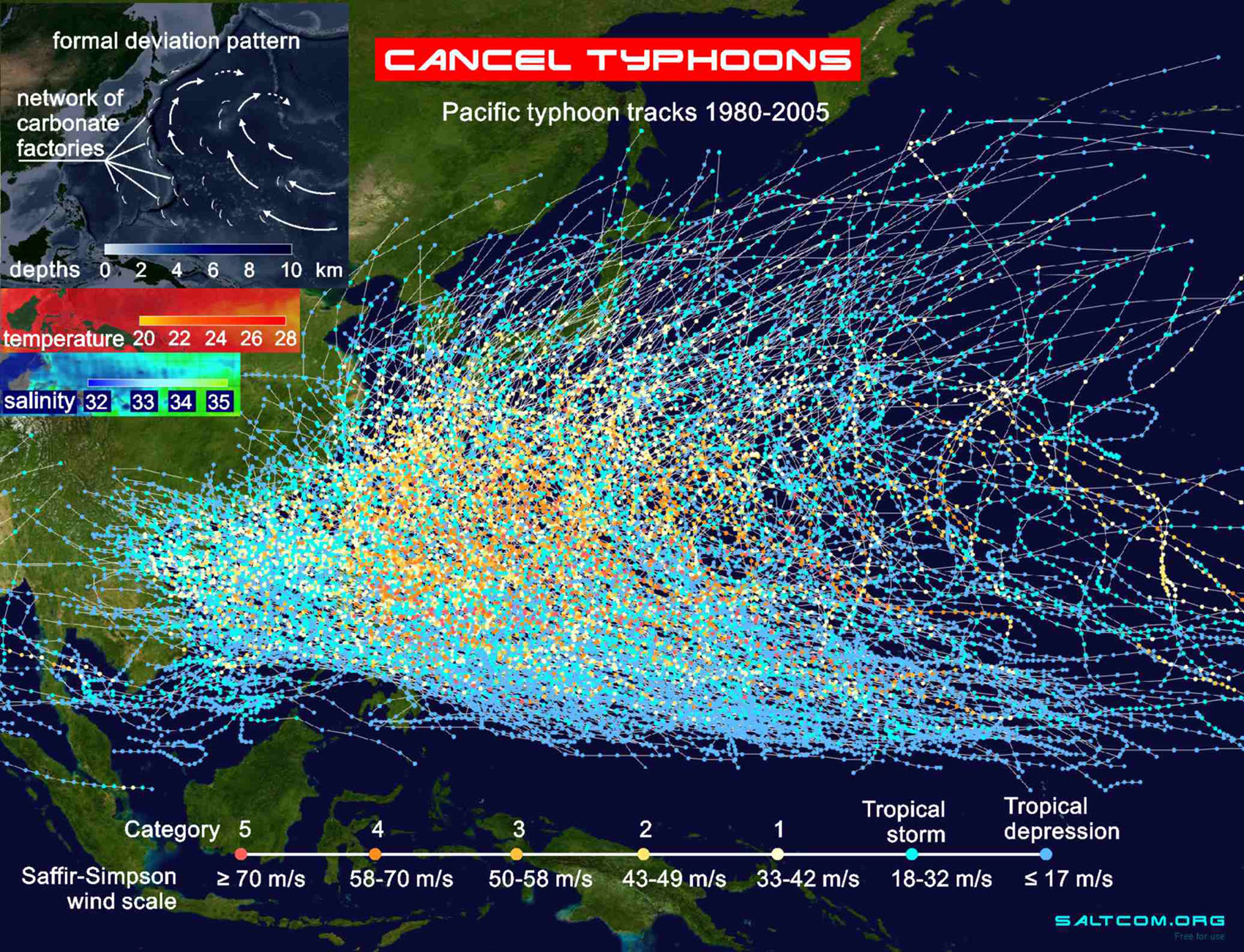
45
|
||||
46

|
||||
47
|
|||
48
|
|||
49
|
|||
50
|
|||
52
|
|||
53
|
|||
|
|
Alle Texte und Bilder sind frei zu verwenden. Sie können kopieren, einfügen, speichern, Bearbeiten, Bearbeiten, senden, empfangen, hochzuladen, zu akzeptieren, zu übertragen, zu verkaufen, zu kaufen, zu profitieren, Stimmen, Streit, zu entwickeln, zu ignorieren, zu Herzen nehmen, alles tun, mit Ihnen, ohne Einschränkung. Freeedom!!! |